EXISTĂ DOVEZI PRIVIND UN PUNCT STABILIT CARE SĂ REGLEZE GREUTATEA CORPULUI UMAN?
Există dovezi pentru un punct stabilit care reglează greutatea corpului uman?
Manfred J Müller,1 Anja Bosy-Westphal,1 and Steven B Heymsfield2
![]()
Articolul original: “Is there evidence for a set point that regulates human body weight?” Publicat online: 2010 Aug 9. doi: 10.3410/M2-59 ; PMCID: PMC2990627 ; PMID: 21173874 ; https://www.ncbi.nlm.nih.gov/pmc/articles/PMC2990627/
Sumar.
Există dovezi pentru ideea că există un control biologic (activ) al greutății corporale, la un anumit punct de referință. Greutatea corporală este produsul efectelor genetice (ADN), al efectelor epigenetice (trăsături ereditare care nu implică modificări ale ADN-ului) și al mediului. Reglarea greutății corporale este asimetrică, fiind mai eficientă ca răspuns la pierderea în greutate decât la creșterea în greutate. Cu toate acestea, reglementarea poate fi pierdută sau camuflată de dietele occidentale, sugerând că eșecul controlului biologic se datorează în principal factorilor externi. În această situație, „punctul de referință” al corpului (adică, o greutate constantă „inerentă” reglată de un sistem de control proporțional al feedback-ului) este înlocuită de diverse „puncte de decantare” care sunt influențate de aportul de energie și macronutrienți pentru corp pentru a realiza un bilanț zero de energie.
Într-o lume a abundenței atât stilul de viață prudent cât și controlul cognitiv sunt condiții prealabile pentru un control biologic eficient și o greutate corporală stabilă. Această idee are, de asemenea, un impact asupra cercetărilor genetice viitoare asupra reglării greutății corporale. Căutarea fondului genetic al creșterii în greutate în exces într-o lume a abundenței este înșelătoare, deoarece posibilul control biologic este umbrit pe larg de efectul mediului. În ceea ce privește practica clinică, abordările dietetice atât pentru pierderea în greutate, cât și pentru creșterea în greutate trebuie reconsiderate. La pacienții subponderali (de exemplu, pacienții cu anorexie nervoasă), creșterea în greutate este susținută de mecanisme biologice care pot sau nu pot fi suprimate prin hiperalimentare. Pentru a depăși contrareglarea indusă de scăderea în greutate a supraponderalității, trebuie luate în considerare semnalele biologice. Modelarea computațională a modificărilor de greutate pe baza fluxului metabolic și a reglării acestuia va oferi strategii viitoare pentru nutriția clinică.
Introducere și context.
Deoarece greutatea corporală este un factor determinant major al sănătății, reglarea și conservarea compoziției corporale sunt probleme care salvează viețile. Sistemul nervos central și sistemele periferice reglează echilibrul energetic și al nutrienților prin mecanisme biologice și comportamentale.
Controalele pe termen scurt includ inițierea și încetarea hrănirii (de exemplu, cauzate de semnale gastro-intestinale), în timp ce controlul pe termen lung al greutății corporale este legat de modificările bilanțului energetic și ale depozitelor de energie. Eficiența reglării greutății corporale este dominată de ambele părți ale bilanțului energetic (atât aportul de energie, cât și cheltuielile de energie), care sunt interconectate funcțional.
Astfel, creșterea fie a aportului alimentar, fie a cheltuielilor de energie sunt asociate cu schimbări corespunzătoare în metabolism și comportament. Mâncarea în exces este urmată de creșteri ale termogenezei, în timp ce creșterea cheltuielilor de energie (de exemplu, din cauza exercițiilor fizice intense) afectează consumul de alimente. Ideea generală este că greutatea corpului uman se află sub un control genetic și umoral suficient de puternic, o viziune inspirată de teoria așa-numitului „punct set”. Această teorie propune un sistem de control proporțional al feedbackului conceput pentru a regla greutatea corporală la o greutate constantă „inerentă corpului”, și anume greutatea punctului setat [1]. Sistemul, conform acestei teorii, ajustează aportul de alimente sau consumul de energie (sau ambele) proporțional cu diferența dintre greutatea corporală curentă și greutatea punctului de referință. Teoria punctului stabilit a provenit din studiile pe animale [2] și de atunci a fost pusă la îndoială la om.
Mulți oameni par să aibă o greutate corporală constantă pe tot parcursul vieții adulte. Cu toate acestea, studiile de intervenție sugerează că un punct de referință la om este „slab” (de exemplu, implicând limite superioare și inferioare), mai degrabă decât strâns controlat [3]. În studiul clasic de înfometare din Minnesota [4], subiecții au pierdut 66% din masa inițială de grăsime ca răspuns la 24 de săptămâni de semi-înfometare (adică cu un aport de energie redus cu 50%), dar re-hrănirea ad libitum a dus la o recăpătare a masei de grăsime atingând 145% din valorile de dinaintea înfometării (adică a existat o depășire a masei de grăsime, cunoscută sub numele de fenomenul de recuperare a grăsimii) [5]. Astfel, fluctuația greutății corporale care rezultă din supraalimentare și supraalimentare necesită o schimbare considerabilă a punctului de stabilire ipotetic, cel puțin după înfometare, re-hrănire și supraalimentare. Modele alternative de reglare a greutății corporale prin urmare (a) implică mai multe stări de echilibru ale greutății corporale, așa-numitele „puncte de decantare”, fără un control de feedback al aportului de energie [1] sau (b) propagă un sistem de control asimetric sau de prag care răspunde la doar echilibrul energetic [2].
Simularea ulterioară a datelor experimentale din Minnesota de înfometare a sugerat că, după re-hrănire, poate dura mai mult de un an pentru ca masa grasă să scadă până la 5% din valoarea inițială [6,7]. Aceste date indică o pierdere tranzitorie a controlului apetitului (și, prin urmare, reglarea greutății corporale) în primele luni de re-hrănire și supraalimentare. Revenirea la un stil de viață înainte de înfometare (și, probabil, sănătos) poate dura perioade mai lungi de timp, pe măsură ce corpul își reconstituie sau resetează sistemul de reglare a greutății corporale. Această constatare poate duce la ipoteza mai generală că biologia reglării greutății corporale este camuflată de hiperfagie (și probabil de un stil de viață occidental).
Controlul aportului de energie este un subiect complex, iar acest control este ceva pe care mulți oameni supraponderali îl pierd pe termen lung. Acest lucru este reflectat de aproape toate experiențele de scădere în greutate ale pacienților obezi care își pierd de obicei respectarea dietei cu timpul [8]. Evident, la greutatea corporală redusă, un nou set sau punct de decantare este greu de stabilit (sau greu de apărat). S-a calculat că la pacienții obezi cu greutate redusă, menținerea greutății corporale pierdute ar fi fost realizată dacă aportul de energie pe parcursul a 2 ani ar fi fost cu 170 kcal / zi (0,7 MJ / zi) mai mic decât înainte de dietă [7]. Eșecul de a păstra aceste mici schimbări în dietă și, astfel, de a menține o greutate redusă, poate fi luat ca dovadă a inexactității sau chiar a ineficienței sistemului nostru de control al greutății pentru a apăra „noul” punct de decontare. Alternativ, recuperarea programată a greutății corporale poate fi, de asemenea, luată ca dovadă a unui set set ridicat, care pare a fi bine apărat la majoritatea pacienților obezi.
Datele din studiile controlate randomizat de pierdere în greutate farmacologică pun sub semnul întrebării existența unui sistem de control al greutății corporale. Atunci când este comparat doar cu restricția dietetică, un blocant al receptorilor canaboid-1 a cauzat pierderi semnificative de greutate pe parcursul a 2 ani (-6,3 kg față de -1,6 kg comparativ cu greutățile dinaintea studiului) [9]. Cu toate acestea, pacienții care au fost trecuți de la medicament la grupul de dietă în al doilea an al protocolului și-au recăpătat greutatea și au atins pierderi de greutate aproape identice după al doilea an (-2,7 kg față de -2,9 kg numai prin dietă comparativ cu greutățile dinaintea studiului) [9]. Aceste date pot fi luate ca dovezi pentru diferite puncte de stabilire. Alternativ, schimbările de greutate au urmat pur și simplu consumul de energie (care a fost mai mic în timpul tratamentului medicamentos decât în timpul dietei), iar greutățile finale ale corpului au reflectat apoi un echilibru energetic nou și zero.
Există câteva linii de dovezi care sugerează că teoria tradițională a punctelor de set pare să fie prea simplistă. Prezentul articol își propune să abordeze următoarele întrebări:
- Există dovezi pentru un punct stabilit în componentele corpului (mai degrabă decât în greutatea corporală)?
- Există un „set” în echilibrul energetic și în metabolismul macronutrienților?
- Este leptina un semnal de reglare a greutății corporale și care este dovada controlului asimetric al greutății corporale?
- Un stil de viață occidental camuflează reglarea biologică a greutății corporale?
Cercetări recente.
Progrese recente au apărut din zona cercetării detaliate a compoziției corporale și din descoperirile recente privind controlul genetic, epigenetic și endocrin al greutății corporale (adică, leptina ca parte a sistemului de reglare a greutății corporale). Pentru a pune aceste date în perspectivă, noile rezultate trebuie discutate în contextul unor rezultate mai vechi din fiziologia integrativă, care au fost frecvent neglijate în cercetările moderne privind controlul genetic al greutății corporale.
Rezultate de traducere
Contribuția variantelor genetice la reglarea greutății corporale este în prezent estimată a fi mică, iar cele mai multe rezultate ale asocierii la nivelul genomului sunt pentru markeri care nu se află în gene cunoscute [10]. În plus, programarea metabolică și influențele epigenetice se adaugă la reglarea greutății corporale. Originile de dezvoltare ale ipotezei sănătății și bolii (de exemplu, ipoteza programării fetale) speculează că supra- și subnutriția maternă afectează mediul in utero inducând astfel răspunsuri adaptative fetale favorizând schimbări pe termen lung și permanente în circuitele hipotalamice ale centrelor de reglare a apetitului, post -supranutriție natală și creșterea excesivă în greutate la descendenți [10].
Imprimarea genomică (inclusiv metilarea ADN și modificarea histonelor) are ca rezultat o discordanță ulterioară între răspunsurile metabolice anticipate de program și mediu. Această idee este susținută de un studiu recent care a constatat că, atunci când se compară descendenții mamelor obeze cu cele ale mamelor obeze care au slăbit în urma unei intervenții chirurgicale de bypass biliopancreatic, prevalența descendenților care erau supraponderali a fost redusă cu 52% după intervenția chirurgicală bypass biliopancreatică maternă. [11]. Aceste date indică rolul factorilor epigenetici în reglarea greutății corporale.
Un progres major recent este modelarea computerizată a modificărilor de greutate pe baza fluxurilor metabolice și a controlului biologic al acestora. Acest lucru se va adăuga la viitoarele strategii de tratament farmacologic și non-farmacologic al problemelor clinice ale supraponderității sau subponderalității. Astăzi, pare probabil că fenotipul (adică un indice de masă corporală obeză [> 30]), influențat de punctele stabilite sau de stabilizare, este produsul efectelor genetice (ADN), ale efectelor epigenetice (trăsături ereditare care nu implică modificări ale ADN) și mediul înconjurător.
Există dovezi pentru un punct stabilit în componentele corpului, mai degrabă decât pentru greutatea corporală?
Greutatea corporală este eterogenă prin aceea că cuprinde multe organe și țesuturi diferite. Într-un model cu două compartimente, greutatea corporală este suma masei grase corporale și a masei slabe sau lipsite de grăsime. Masa slabă constă din masă osoasă, de apă extracelulară și celulă corporală; masa celulelor corpului include apă intracelulară, glicogen și proteine. Din punct de vedere anatomic, țesutul slab cuprinde o serie de organe sau componente individuale, cum ar fi mușchiul scheletic, ficatul, creierul, inima și rinichii. La un bărbat de 70 kg, aceste componente reprezintă 40%, 2,6%, 2,0%, 0,5% și, respectiv, 0,4% din greutatea corporală [12]. Unele greutăți componente sunt corelate (de exemplu, există o corelație pozitivă între masa musculară și masa osoasă), dar pentru alte componente (inclusiv osul și creierul), greutățile lor nu sunt asociate între ele [13]. Această lipsă de asociere argumentează împotriva unei reglementări comune a masei organelor și țesuturilor individuale și, prin urmare, a greutății corporale globale. În schimb, pare mai probabil ca masa individuală de organe și țesuturi să fie reglementată diferit.
Răspunsul de reglementare a greutății corporale poate proveni din masa grasă [2,5]. Atât lipectomia chirurgicală, cât și transplantul de țesut adipos alb la animale duc la modificări compensatorii pentru a apăra grăsimea corporală totală [14]. În studiul din Minnesota, hiperfagia post-foamete a fost legată de măsura în care grăsimea corporală a fost epuizată [4,5], sugerând că dorința de a mânca în exces face parte dintr-un sistem de reglementare care funcționează pentru restabilirea masei grase. În plus, există suficiente dovezi pentru semnale de feedback umoral care influențează masa grasă corporală, iar studiile asupra fenotipurilor extreme de obezitate umană (de exemplu, copiii care sunt obezi de la o vârstă fragedă) sugerează că eficiența sau ineficiența cu care acționează aceste procese poate fi ereditar [15]. Cu toate acestea, țesutul adipos este eterogen în ceea ce privește localizarea, cantitatea prezentă, funcțiile metabolice și răspunsul la modificările de greutate [16,17].
Acest concept implică faptul că este necesară o căutare a reglării depozitelor individuale de țesut adipos, mai degrabă decât a țesutului adipos total al corpului. Există unele dovezi recente care sugerează că distribuția țesutului adipos este programată genetic (sau epigenetic) [18]. Scăderea în greutate indusă de dietă la subiecții supraponderali nu afectează distribuția țesutului adipos, ceea ce implică faptul că diferitele depozite (de exemplu, viscerale și subcutanate) sunt reduse cu scăderea în greutate [16,17,19]. Cu toate acestea, există pierderi preferențiale de țesut adipos visceral [20] și grăsime ectopică în ficat și acestea sunt epuizate în mod disproporționat odată cu pierderea în greutate [17].
Există un „set” în echilibrul energetic și în metabolismul macronutrienților?
Creșterea cheltuielilor de energie poate crește consumul de energie, în timp ce creșterea consumului de energie nu crește intrinsec activitatea și cheltuielile de energie [21]. Cu toate acestea, cu exerciții fizice intense și cheltuieli energetice foarte mari, aportul de energie nu poate fi ajustat în mod adecvat, iar echilibrul energetic devine negativ [22]. Compensarea metabolică este evidentă în timpul supraalimentării controlate și supraalimentării (adică în timpul schimbărilor rapide de la echilibrul energetic la un dezechilibru negativ sau pozitiv) [23-25]. Cu subalimentarea și pierderea în greutate, cheltuielile totale de energie (adică 24 de ore) (TEE), cheltuielile de energie de repaus (REE), efectul termic al meselor și activitatea fizică (PA) scad [4,6,24-26], întrucât creșteri ale TEE și REE (dar nu PA) sunt observate ca răspuns la supraalimentare și la creșterea în greutate [6,23,25,27].
Modificările metabolice depășesc modificările masei țesuturilor active din punct de vedere metabolic (adică nu au fost explicate prin modificări ale masei corporale) și, prin urmare, se datorează parțial scăderii sau creșterii ratei respirației celulare. Răspunsul metabolic al întregului corp la supraalimentare și supraalimentare este cauzat de o interacțiune a ratelor metabolice în organele individuale (de exemplu, inimă, ficat, rinichi, mușchi scheletic și creier), iar acest lucru se explică din nou prin modificări ale sistemului nervos simpatic. activitate, în concentrațiile plasmatice de hormoni tiroidieni și leptină și în sensibilitatea la insulină [7,28]. Aceste adaptări metabolice urmăresc diminuarea dezechilibrului energetic (pentru a ajunge în cele din urmă la un nou echilibru între aportul de energie și cheltuielile de energie) și astfel se adaugă stabilității pe termen lung a greutății [29]. Această idee argumentează în favoarea unui „set” pentru a atinge un echilibru energetic zero la o anumită greutate corporală, ceea ce are ca rezultat mai multe puncte de decantare decât un punct setat.
În ceea ce privește comparația diferitelor depozite de energie, depozitele de grăsimi, proteine și carbohidrați diferă în ceea ce privește ambele (a) magnitudine (adică, la un bărbat de 70 kg, aproximativ 140.000 kcal [sau 586 MJ] ca grăsime, 24.000 kcal [ 100 MJ] ca proteină, 600 kcal [2,5 MJ] ca carbohidrați) și (b) reglare [29]. Pe termen lung, echilibrul carbohidraților este strâns reglementat și un semnal de reacție la glicogen acționează pentru corectarea oxidării glucozei și, astfel, a dezechilibrelor carbohidraților [23,30]. Astfel, o scădere minoră a glicogenului hepatic (de exemplu, cauzată de o dietă cu conținut scăzut de carbohidrați, cu conținut ridicat de grăsimi) mărește volumul alimentar pentru a umple depozitele de glicogen (care vor lua, de asemenea, o cantitate mare de grăsimi și astfel vor crește masa de grăsime în cazul unei diete cu conținut scăzut
În schimb, dezechilibrele de proteine și grăsimi nu sunt strâns controreglate, ceea ce duce la pierderi sau câștiguri mai mari în aceste componente individuale ca răspuns la aportul de nutrienți. Asimilarea întregului corp și a celulelor de carbohidrați, grăsimi și proteine din dietă este însoțită de ratele lor de utilizare. Există o ierarhie a oxidării substratului post-prandial, iar aportul de grăsime nu a stimulat oxidarea grăsimilor [32,33], iar acest lucru explică fluctuații mari ale masei grase ca răspuns la aporturile variate de grăsimi [33]. Luate împreună, aceste date sugerează că echilibrul glucidic, mai degrabă decât echilibrul proteic și al grăsimilor, este reglementat ca parte a unui sistem de reglare a greutății corporale presupuse. Dacă depozitele de glicogen servesc ca „set” pentru greutatea corporală, atunci variația greutății corporale este mai degrabă o reflectare a conținutului de grăsime din dietă decât a unei reglementări active.
Este leptina un semnal de feedback al reglării greutății corporale?
Care este dovada controlului asimetric? În ultimii 15-20 de ani, progresul în înțelegerea neurobiologiei poftei de mâncare și a sațietății a dus la caracterizarea rețelelor fascinante de hormoni, peptide și monoamine ca parte a sistemului de control al apetitului. Cu toate acestea, controlul endogen al aportului de energie nu este încă complet caracterizat, iar factorii externi (de exemplu, mediul care promovează obezitatea) pot anula controalele endogene. Nu se cunoaște în prezent modul în care factorii biologici (de exemplu, hormonii) se combină cu factori externi (de exemplu, aprovizionarea cu alimente) pentru a controla consumul de alimente. În plus, impactul adaptării metabolice asupra consumului de energie și macronutrienți rămâne de caracterizat.
Majoritatea cercetărilor recente privind reglarea greutății corporale se bazează pe ideea că centrele creierului, inclusiv cele situate în hipotalamus, primesc semnale periferice care reflectă depozitele de energie și grăsimi. Studiile timpurii de parabioză au dat primele dovezi puternice că șoarecii obezi genetic nu aveau un semnal secretor de la țesutul adipos care reprimă consumul de alimente [34]. Un semnal homeostatic relevant în reglarea greutății corporale (sau a masei grase) este prototipul adipokinei leptină [35,36]. Leptina este derivată din celulele grase proporțional cu masa grasă, iar una dintre sarcinile leptinei este de a trimite semnale cu privire la nivelurile de masă grasă (sau modificări ale masei grase) către hipotalamus, care la rândul său reglează atât o scădere a aportului de energie, cât și o creștere în cheltuieli energetice.
Acesta este un exemplu de control proporțional al feedback-ului, deoarece aportul de alimente și cheltuielile de energie sunt ajustate proporțional cu diferența dintre concentrația plasmatică de leptină și valoarea sa setată [1]. Cu toate acestea, dovezile actuale sugerează că leptina nu protejează în primul rând corpul împotriva creșterii masei grase, ci în schimb apără organismul împotriva pierderii de grăsime, operând astfel doar în caz de echilibru energetic negativ (de exemplu, există un răspuns asimetric sau de prag la leptină la numai concentrații scăzute) [2,37,38].
Nivelurile scăzute de leptină, care indică lipsa de alimente și depozitele de grăsime epuizate, sunt un semnal pentru a induce acțiuni biologice adaptive care conduc la o creștere a aportului de energie (ceea ce nu se poate sau nu se întâmplă în cazul lipsei de alimente sau a tulburărilor alimentare) și pentru a reduce cheltuielile de energie [39,40]. De exemplu, linia de corelație care demonstrează relația dintre leptină și REE, ajustată pentru masa fără grăsime, este abruptă la niveluri scăzute de leptină și plană la niveluri normale de leptină, sugerând că efectul leptinei asupra REE diferă la diferite concentrații de leptină cu o efect doar la concentrații scăzute [40]. Acest exemplu subliniază faptul că controlul masei individuale a componentelor corpului (de exemplu, grăsime) depinde de echilibrul energetic și poate fi eficient ca răspuns doar la echilibrul energetic negativ și la post. Un sistem de control asimetric este în concordanță cu experiența că este mai ușor să te îngrași decât să slăbești. În timp ce acesta din urmă este strict controlat, primul pare să nu fie complet compensat. Această idee pune, de asemenea, la îndoială ipoteza că rezistența la leptină, așa cum sugerează nivelurile ridicate de leptină plasmatică, provoacă obezitate.
Un stil de viață occidental camuflează reglarea biologică a greutății corporale?
Datele observaționale și experimentale umane oferă unele dovezi pentru controlul biologic al greutății corporale. Cu toate acestea, având în vedere epidemia actuală de obezitate, aceasta poate reflecta o copleșire colectivă a sistemelor biologice de control al greutății corporale. De fapt, „frânele” biologice sunt considerate a fi slabe și nu funcționează într-adevăr într-un mediu care promovează obezitatea. Acest eșec face parte din așa-numitul model de „tren de creștere în fugă” care a fost propus pentru a perpetua obezitatea și pentru a accelera și mai mult epidemia de obezitate [41]. Cu toate acestea, la un echilibru zilnic, creșterea excesivă în greutate este un eșec în reglarea fină a echilibrului energetic, iar obezitatea rezultă dintr-un echilibru energetic cronic (dar mic) pozitiv. Așa-numitul decalaj energetic (adică, dezechilibrul zilnic dintre aportul de energie și consumul de energie, rezultând creșterea în greutate în exces) este de aproximativ 50-150 kcal / zi (0,2 - 0,6 MJ / zi) numai (corespunzând la 5% din energia zilnică aport) [42,43].
Acest lucru este în concordanță cu datele longitudinale care arată că o diferență în cheltuielile de energie de aproximativ 70 kcal / zi a fost asociată cu diferențe în creșterea în greutate [44]. Toate aceste date indică necesitatea unei potriviri precise între aportul de energie și cheltuielile de energie. Astfel, o nepotrivire între cele două sugerează că reglementarea nu este precisă. Unele dintre schimbările metabolice observate la subiecții supraponderali (de exemplu, creșterea cheltuielilor de energie și oxidarea grăsimilor) contribuie la limitarea creșterii în greutate ca răspuns la supraalimentarea cronică și urmăresc să ajungă la o nouă stare de echilibru (adică la un punct de decantare), mai degrabă decât la restabiliți greutatea corporală inițială [29]. Este evident că în condițiile stilului de viață occidental, răspunsurile compensatorii sunt mai degrabă pasive decât active și au astfel un impact limitat asupra reglării greutății corporale.
Este tentant să speculăm că controlul imperfect al greutății corporale se datorează obiceiurilor noastre actuale de viață, care compensează controlul biologic. Această idee este în concordanță cu studiile pe animale în care așa-numitele diete de cafenea (sau occidentale) au dus la hiperfagie (adică, animalele au pierdut controlul aportului), creștere progresivă în greutate și obezitate în comparație cu o dietă normală de chow [45]. Revenind din nou la o dietă chow, șobolanii și-au normalizat greutățile corpului (adică animalele și-au reglat greutatea la nivelurile anterioare) și, pe termen lung, acest lucru a dus la o traiectorie normală a greutății [45].
Acest lucru este în concordanță cu datele umane care arată că alimentele bogate în energie, care sunt bogate în grăsimi și zahăr, provoacă supraalimentare „pasivă” și, astfel, creștere în greutate [46]. Prin contrast, o dietă tradițională ad libitum, cu conținut scăzut de grăsimi, cu conținut ridicat de carbohidrați, a dus la o revenire spontană la aportul obișnuit de energie (în termen de 3 luni) și la o recuperare a greutății corporale inițiale (în termen de 2,5 ani) după supraalimentarea masivă, cu 19 ± 3,2 kg a creșterii în greutate a bărbaților tineri slabi din Camerun [47]. Un regulament set point a fost, de asemenea, evident în cadrul unei diete tradiționale cu conținut scăzut de grăsimi și a fluctuațiilor sezoniere (cauzate de o lipsă anuală de alimente) în greutatea corporală a femeilor din Gambia din mediul rural [48]. În ciuda ciclului de greutate repetat pe o perioadă de 10 ani, greutatea corporală minimă a rămas destul de stabilă (în limita a ± 1,5 kg).
Implicații pentru practica clinică.
În ceea ce privește practica clinică, abordările dietetice atât pentru pierderea în greutate, cât și pentru creșterea în greutate trebuie reconsiderate. La pacientul subponderal, creșterea în greutate este susținută de mecanisme biologice care ar putea fi suprimate parțial de hiperalimentarea agresivă. În schimb, pentru a depăși contrareglarea indusă de scăderea în greutate în supraponderalitate, trebuie luate în considerare semnalele biologice (adică scăderea asociată scăderii în greutate a nivelului de leptină plasmatică și T3 [triiodotironină]). Dovezile sugerează că înlocuirea leptinei poate ajuta la reconstituirea controlului biologic. În plus, modelarea modificărilor de greutate (de exemplu, la pacienții cu cancer cahectic) [49] bazată pe controlul biologic al greutății corporale oferă noi concepte în tratamentul farmacologic și non-farmacologic al subponderalității.
„Punct set și puncte de decantare” în loc de „set point versus punct de decantare”. Luate colectiv, aceste date oferă dovezi pentru ideea că există un control biologic (activ) al greutății corporale și, de asemenea, al stabilității greutății (și, prin urmare, un punct de referință la o stare echilibrată sănătoasă) ca răspuns la consumul unor diete sănătoase de chow. În schimb, această reglementare este pierdută sau camuflată de dietele occidentale, sugerând că eșecul controlului biologic se datorează în principal factorilor externi. În această situație, punctul de referință este înlocuit de diverse puncte de decantare care sunt influențate de aportul de energie și macronutrienți pentru ca organismul să atingă un echilibru zero de energie și macronutrienți și, astfel, o stare de echilibru nouă și posibil nesănătoasă. Dietele occidentale pot avea un risc mai mare la subiecții care sunt eficienți în aportul sau metabolismul energiei alimentare, așa-numitele genotipuri economice, cărora li s-a propus să aibă o predispoziție genetică sau un punct de referință ridicat. Cu toate acestea, dovezile prezente din fiziologia integrativă duc la răspunsuri simple, mai degrabă decât la răspunsuri sofisticate.
„Punct set și puncte de decantare” în loc de „set point versus punct de decantare”.
Luate colectiv, aceste date oferă dovezi pentru ideea că există un control biologic (activ) al greutății corporale și, de asemenea, al stabilității greutății (și, prin urmare, un punct de referință la o stare echilibrată sănătoasă) ca răspuns la consumul unor diete sănătoase de chow. În schimb, această reglementare este pierdută sau camuflată de dietele occidentale, sugerând că eșecul controlului biologic se datorează în principal factorilor externi. În această situație, punctul de referință este înlocuit de diverse puncte de decantare care sunt influențate de aportul de energie și macronutrienți pentru ca organismul să atingă un echilibru zero de energie și macronutrienți și, astfel, o stare de echilibru nouă și posibil nesănătoasă. Dietele occidentale pot avea un risc mai mare la subiecții care sunt eficienți în aportul sau metabolismul energiei alimentare, așa-numitele genotipuri economice, cărora li s-a propus să aibă o predispoziție genetică sau un punct de referință ridicat. Cu toate acestea, dovezile prezente din fiziologia integrativă duc la răspunsuri simple, mai degrabă decât la răspunsuri sofisticate.
Într-o lume a abundenței, un stil de viață prudent și, prin urmare, controlul cognitiv (adică „de la instinct la intelect”) [50] sunt condiții prealabile ale controlului biologic eficient, al unei greutăți corporale stabile și, astfel, de menținere a unui punct de referință. Această idee este adevărată chiar și la acei oameni care pot avea un aport sau un metabolism eficient al energiei alimentare (adică, genotipul economisitor) [10], deoarece mutația putativă este eficientă numai la aportul mare de energie și grăsimi. În acest sens, pierderea punctului stabilit (sau sfârșitul prin diferite puncte de stabilire) a greutății corporale poate servi ca un alt exemplu de „paradigmă minte-corp” (de exemplu, la obezi, există un „decalaj minte-corp” și deci o pierdere a controlului biologic).
Această idee are, de asemenea, un impact asupra cercetărilor viitoare privind reglarea greutății corporale. Căutarea fondului genetic al creșterii în greutate în exces într-o lume a abundenței este înșelătoare, deoarece posibilul control biologic este umbrit pe larg de efectul mediului. În consecință, factorii de mediu, mai degrabă decât fiziologia (inclusiv fundalul genetic), trebuie abordați pentru a aborda obezitatea umană la nivel de populație, nesindromică. Este interesant de remarcat faptul că componentele fundamentale ale echilibrului energetic, inclusiv efectul mediului, sunt bine conservate între specii. De exemplu, obezitatea canină este strâns asociată cu consumul de gustări și starea socio-economică scăzută, sugerând că problema supraponderalității nu este o problemă unică a omului [51].
|
Mulțumiri.
Datele noastre proprii au fost susținute de „Rețeaua de competențe privind obezitatea”, finanțat de Ministerul Federal al Educației și Cercetării (FKZ: 01GI0821) și de Deutsche Forschungsgemeinschaft (Fundația Germană pentru Cercetare) (DFG Mü 714 / 8-3 și DFG Bo3296 / 1- 1). Abrevieri. Activitate fizică PA REE cheltuieli energetice restante TEE cheltuieli totale de energie |
Note Versiunea electronică a acestui articol este cea completă și poate fi găsită la: http://f1000.com/reports/m/2/59
Note
Interese concurente: Autorii declară că nu au interese concurente.
Referințe
- Hall KD, Heymsfield SB. Models use leptin and calculus to count calories. Cell Metab. 2009;9:3–4. doi: 10.1016/j.cmet.2008.12.006. [PubMed] [CrossRef] [Google Scholar]
- Leibel RL. Molecular physiology of weight regulation in mice and humans. Intern J Obes. 2008;32:S98–S108. doi: 10.1038/ijo.2008.245. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Garrow JS. Obesity and Related Diseases. Edinburgh: Churchill Livingstone; 1988. [Google Scholar]
- Keys A. The Biology of Human Starvation. Minneapolis, MN: University of Minnesota; 1950. [Google Scholar]
- Dulloo AG, Jacquet J, Girardier L. Poststarvation hyperphagia and body fat overshooting in humans: a role for feedback signals from lean and fat tissues. Am J Clin Nutr. 1997;65:717–23. [PubMed] [Google Scholar]
- Hall KD. Computational model of in vivo energy metabolism during semistarvation and refeeding. Am J Physiol Endocrinol Metab. 2006;291:E23–37. doi: 10.1152/ajpendo.00523.2005. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Hall KD. Predicting metabolic adaptation, body weight change, and energy intake in humans. Am J Physiol Endocrinol Metab. 2010;298:E449–66. doi: 10.1152/ajpendo.00559.2009. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Svetkey LP, Stevens VJ, Brantley PJ, Appel LJ, Hollis JF, Loria CM, Vollmer WM, Gullion CM, Funk K, Smith P, Samuel-Hodge C, Myers V, Lien LF, Laferriere D, Kennedy B, Jerome GJ, Heinith F, Harsha DW, Evans P, Erlinger TP, Dalcin AT, Coughlin J, Charleston J, Champagne CM, Bauck A, Ard JD, Aicher K, Weight Loss Maintenance Collaborative Research Group Comparison of strategies for sustaining weight loss: the weight loss maintenance randomized controlled trial. JAMA. 2008;299:1139–48. [PubMed] [Google Scholar]
- Pi-Sunyer FX, Aronne LJ, Heshmati HM, Devin J, Rosenstock J, RIO-North America Study Group Effect of rimonabant, a cannaboid-1 receptor blocker, on weight and cardiometabolic risk factors in overweight or obese patients: RIO-North America: a randomized controlled trial. JAMA. 2006;295:761–75. [PubMed] [Google Scholar]
- Walley AJ, Asher JE, Froguel P. The genetic contribution to non-syndromic human obesity. Nat Rev Genet. 2009;10:431–42. doi: 10.1038/nrg2594. [PubMed] [CrossRef] [Google Scholar] F1000 Factor 6.0 Must Read
Evaluated by Anke Hinney 07 Sep 2009 - Kral JG, Biron S, Simard S, Hould F-S, Lebel S, Marceau S, Marceau P. Large maternal weight loss from obesity surgery prevents transmission of obesity to children who were followed for 2 to 18 years. Pediatrics. 2006;118:e1644–9. [PubMed] [Google Scholar]
- Later W, Bosy-Westphal A, Hitze B, Kossel E, Glüer CC, Heller M, Müller MJ. No evidence of mass dependency of specific organ metabolic rate in healthy humans. Am J Clin Nutr. 2008;88:1004–9. [PubMed] [Google Scholar]
- Müller MJ, Bosy-Westphal A, Krawczak M. Genetic studies of common types of obesity: a critique of the current use of phenotypes. Obes Rev. 2010;11:612–8. doi: 10.1111/j.1467-789X.2010.00734.x. [PubMed] [CrossRef] [Google Scholar]
- Mauer MM, Harris RBS, Bartness TJ. The regulation of body fat: lessons learned from lipectomy studies. Neurosci Biobehav Rev. 2001;25:15–28. doi: 10.1016/S0149-7634(00)00047-6. [PubMed] [CrossRef] [Google Scholar]
- O’Rahilly S, Farooqi IS. Human obesity as a heritable disorder of the central control of energy balance. Int J Obes. 2008;32:S55–S61. doi: 10.1038/ijo.2008.239. [PubMed] [CrossRef] [Google Scholar]
- Jansen J, Fortier A, Hudson R, Ross R. Effects of energy-restrictive diet with or without exercise on abdominal fat, intermuscular fat, and metabolic risk factors in obese women. Diabetes Care. 2002;25:431–8. doi: 10.2337/diacare.25.3.431. [PubMed] [CrossRef] [Google Scholar]
- Bosy-Westphal A, Kossel E, Goele K, Blöcker T, Lagerpusch M, Later W, Heller M, Glüer CC, Müller MJ. Association of pericardial fat with liver fat and insulin sensitivity after diet-induced weight loss in overweight women. Obesity (Silver Spring) 2010 [Epub ahead of print] [PubMed] [Google Scholar]
- Malis C, Rasmussen EL, Poulsen P, Petersen I, Christensen K, Beck-Nielsen H, Astrup A, Vaag AA. Total and regional fat distribution is strongly influenced by genetic factors in young and elderly twins. Obes Res. 2005;13:2139–45. doi: 10.1038/oby.2005.265. [PubMed] [CrossRef] [Google Scholar]
- Redman LM, Heilbronn LK, Martin CK, Alfonso A, Smith SR, Ravussin E, Pennington CALERIE team Effect of calorie restriction with and without exercise on body composition and fat distribution. J Clin Endocrin Metab. 2007;92:865–72. doi: 10.1210/jc.2006-2184. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Chaston TB, Dixon JB. Factors associated with percent change in visceral versus subcutaneous abdominal fat during weight loss: findings from a systematic review. Int J Obes. 2008;32:619–28. doi: 10.1038/sj.ijo.0803761. [PubMed] [CrossRef] [Google Scholar]
- Westerterp KR. Physical activity, food intake, and body weight regulation: insights from doubly labelled water studies. Nutr Rev. 2010;68:148–54. doi: 10.1111/j.1753-4887.2010.00270.x. [PubMed] [CrossRef] [Google Scholar]
- Westerterp K. Alterations in energy balance with exercise. Am J Clin Nutr. 1998;68:970S–974S. [PubMed] [Google Scholar]
- Jebb SA, Prentice AM, Goldberg GR, Murgatroyd PR, Black AE, Coward WA. Changes in macronutrient balance during over- and underfeeding assessed by 12-d continuous whole body calorimetry. Am J Clin Nutr. 1996;64:259–66. [PubMed] [Google Scholar]
- Leibel RL, Rosenbaum M, Hirsch J. Changes in energy expenditure resulting from altered body weight. N Engl J Med. 1995;332:621–8. doi: 10.1056/NEJM199503093321001. [PubMed] [CrossRef] [Google Scholar]
- Müller MJ, Bosy-Westphal A, Later W, Haas V, Heller M. Functional body composition - insights into regulation of energy metabolism and some clinical applications. Eur J Clin Nutr. 2009;63:1045–56. doi: 10.1038/ejcn.2009.55. [PubMed] [CrossRef] [Google Scholar]
- Redman LM, Heilbronn LK, Martin CK, de Jonge L, Williamson DA, Delany JP, Ravussin E, Pennington CALERIE team Metabolic and behavioural compensations in response to caloric restriction: implications for the maintenance of weight loss. PLoS One. 2009;4:e4377. doi: 10.1371/journal.pone.0004377. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Diaz EO, Prentice AM, Goldberg GR, Murgatroyd PR, Coward WA. Metabolic response to experimental overfeeding in lean and overweight healthy volunteers. Am J Clin Nutr. 1992;56:641–55. [PubMed] [Google Scholar]
- Bosy-Westphal A, Goele K, Later W, Hitze B, Kossel E, Settler U, Heller M, Glüer C-C, Heymsfield SB, Müller MJ. Contribution of individual organ mass loss to weight loss-associated decline in resting energy expenditure. Am J Clin Nutr. 2009;90:993–1001. doi: 10.3945/ajcn.2008.27402. [PubMed] [CrossRef] [Google Scholar]
- Jequier E, Tappy L. Regulation of body weight. Physiol Rev. 1999;79:451–80. [PubMed] [Google Scholar]
- Flatt JP. Carbohydrate balance and body-weight regulation. Proc Nutr Soc. 1996;55:449–65. doi: 10.1079/PNS19960041. [PubMed] [CrossRef] [Google Scholar]
- Astrup A, Flatt JP. Metabolic determinants of body weight regulation. In: Bouchard C, Bray GA, editors. Regulation of Body Weight: Biological and Behavioural Mechanisms. Chichester: John Wiley & Sons; 1996. pp. 193–210. [Google Scholar]
- Flatt JP, Ravussin E, Acheson KJ, Jequier E. Effects of dietary fat on postprandial substrate oxidation and carbohydrate and fat balances. J Clin Invest. 1985;76:1019–24. doi: 10.1172/JCI112054. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Prentice AM. Manipulation of dietary fat and energy density and subsequent effects on substrate flux and food intake. Am J Clin Nutr. 1998;67:535S–541S. [PubMed] [Google Scholar]
- Coleman DL. Obese and diabetes: two mutant genes causing diabetes-obesity syndromes in mice. Diabetologia. 1978;14:141–8. doi: 10.1007/BF00429772. [PubMed] [CrossRef] [Google Scholar]
- Friedman JM. Leptin at 14y of age: an ongoing story. Am J Clin Nutr. 2009;89(Suppl):973S–979S. doi: 10.3945/ajcn.2008.26788B. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Blüher S, Mantzoros CS. Leptin in humans: lessons from translational research. Am J Clin Nutr. 2009;89(Suppl):991S–997S. doi: 10.3945/ajcn.2008.26788E. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Prentice AM, Moore SE, Collinson AC, O’Connell MA. Leptin and undernutrition. Nutr Rev. 2002;60:S56–S67. doi: 10.1301/002966402320634940. [PubMed] [CrossRef] [Google Scholar]
- Tam J, Fukumura D, Jain RK. A mathematical model of murine metabolic regulation by leptin: energy balance and defense of a stable body weight. Cell Metab. 2009;9:52–63. doi: 10.1016/j.cmet.2008.11.005. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Rosenbaum M, Goldsmith R, Bloomfield D, Magnano A, Weimer L, Heymsfield S, Gallagher D, Mayer L, Murphy E, Leibel RL. Low-dose leptin reverses skeletal muscle autonomic, and neuoendorine adaptations to maintenance of reduced weight. J Clin Invest. 2005;115:3579–86. doi: 10.1172/JCI25977. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Haas V, Gaskin KJ, Kohn MR, Clarke SD, Müller MJ. Different thermic effects of leptin in adolescent females with varying body fat content. Clin Nutr. 2010 [Epub ahead of print] [PubMed] [Google Scholar]
- Swinburn B, Egger G. The runaway weight gain train: too many accelerators, not enough breaks. BMJ. 2004;329:736–9. [PMC free article] [PubMed] [Google Scholar]
- Plachta-Danielzik S, Landsberg B, Bosy-Westphal A, Johannsen M, Lange D, Müller MJ. Energy gain and energy gap in normal-weight children: longitudinal data of the KOPS. Obesity (Silver Spring) 2008;16:777–83. doi: 10.1038/oby.2008.5. [PubMed] [CrossRef] [Google Scholar]
- Hill JO, Wyatt HR, Reed GW, Peters JC. Obesity and the environment: where do we go from here? Science. 2003;299:853–5. doi: 10.1126/science.1079857. [PubMed] [CrossRef] [Google Scholar]
- Ravussin E, Lillioja S, Knowler WC, Christin L, Freymond D, Abbott WGH, Boyce V, Howard BV, Bogardus C. Reduced rate of energy expenditure as a risk factor for body weight gain. N Engl J Med. 1988;318:467–82. doi: 10.1056/NEJM198802253180802. [PubMed] [CrossRef] [Google Scholar]
- Rothwell NJ, Stock MJ. A role for brown adipose tissue in diet-induced thermogenesis. Nature. 1979;281:31–5. doi: 10.1038/281031a0. [PubMed] [CrossRef] [Google Scholar]
- Prentice AM, Poppitt SD. Importance of energy density and macronutrients in the regulation of energy intake. Int J Obes. 1996;20(Suppl 2):S18–S23. [PubMed] [Google Scholar]
- Pasquet P, Apfelbaum M. Recovery of initial body weight and composition after long-term massive overfeeding in men. Am J Clin Nutr. 1994;60:861–3. [PubMed] [Google Scholar]
- Prentice AM, Jebb SA, Goldberg GR, Coward WA, Murgatroyd PR, Poppitt SD, Cole TJ. Effects of weight cycling on body composition. Am J Clin Nutr. 1992;56:209S–216S. [PubMed] [Google Scholar]
- Hall KD, Baracos VE. Computational modelling of cancer cachexia. Curr Opinion Clin Nutr Metab Care. 2008;11:214–21. doi: 10.1097/MCO.0b013e3282f9ae4d. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Peters JC, Wyatt HR, Donahoo WT, Hill JO. From instinct to intellect: the challenge of maintaining healthy weight in the modern world. Obes Rev. 2002;3:69–74. doi: 10.1046/j.1467-789X.2002.00059.x. [PubMed] [CrossRef] [Google Scholar]
- Courcier EA, Thomson RM, Mellor DJ, Yam PS. An epidemiological study of environmental factors associated with canine obesity. J Small Anim Pract. 2010;51:362–7. doi: 10.1111/j.1748-5827.2010.00933.x. [PubMed] [CrossRef] [Google Scholar]
....................
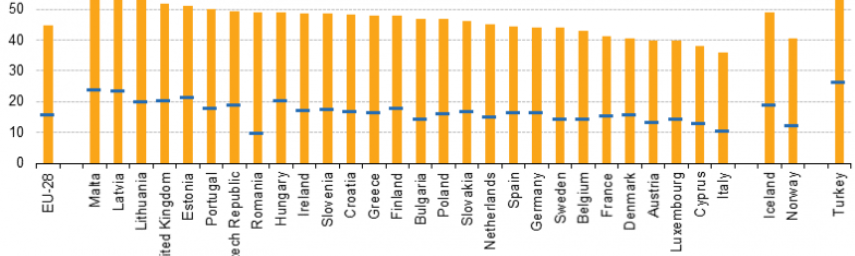
Ilustratia articolului prezintă statistici privind proporția populației supraponderale sau obeze din Uniunea Europeană (UE). Problemele de greutate și obezitatea cresc rapid în majoritatea statelor membre ale UE, cu estimări de 51,6% din populația UE (peste 18 ani) supraponderală în 2014. Proportion of overweight and of obese women, 2014 , (%). Source: Eurostat (hlth_ehis_bm1e)
